(最新)医疗器械GSP条款详解(新旧条款逐条对比版)240115
VIP免费



摘要:
展开>>
收起<<
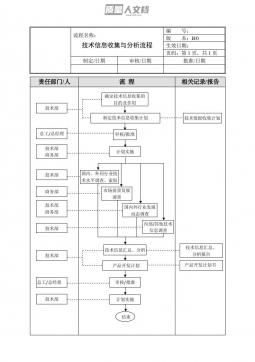
《医疗器械经营质量管理规范》条款详解2024年1月国家药监局器械监管司杨志强目录02新模式新业态质量管理要求01条款详解(新旧对比)03经营环节常见违法违规行为警示04发布实施Ø此次《规范》的修订由原来的九章66条,变为了十章116条;Ø从章节架构上,与14版相比,新增了“第二章质量管理体系建立与改进”;Ø其他章节和名称与14版保持一致。新修订GSP总体变化条款详解(新旧对比)01逐条详解新版GSP(2023)第一章总则8第一条~第八条第二章质量管理体系建立与改进5第九条~第十三条第三章职责与制度10第十四条~第二十三条第四章人员与培训10第二十四条~第三十三条第五章设施与设备19第三十四条~...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
作者:胖子
分类:培训考试
价格:50质量币
属性:115 页
大小:11.01MB
格式:PDF
时间:2024-07-05