ASTM E2500-25 药品的规格、设计与验证以及生物制药生产系统装备科学与基于风险的方法1(中文)
VIP免费
本国际标准是根据世界贸易组织技术性贸易壁垒委员会(TBT)发布的《关于制定国际标准、指南和建议的原则的决定》中确立的国际公认标准化原则制定的。
Designation:E2500-25
INTERATIONAL
标准指南
药品的规格、设计与验证
以及生物制药生产系统
装备科学与基于风险的方法1
本标准采用固定编号E2500发布;紧随编号后的数字表示发布年份。
原始采纳年份,或在修订情况下,末次修订年份。括号内数字表示末次重新批准年份。
上标ε(e)表示自上次修订或重新批准以来的编辑变更
1. 范围
1.1 本指南适用于制药和生物制药生产系统的所有要
素,包括:药品生产质量管理规范(GMP)公用设备、工
艺设备、辅助公用设备、相关工艺监控和控制系统以及可
能影响产品质量、可用性和/或患者安全的自动化系统。
1.2 出于简洁考虑,
本指南中将这些称为制造系统。
1.3 本指南也可适用于实验室、医疗器械制造系统(实
验室仪器确认涵盖在USP中<1058>),以及信息(软件确
认涵盖在 ISPE GAMP系列文件中;医疗器械制造的风险管
理涵盖在ISO 14971中)。
1.4 本指南适用于新建和现有制造系统。该方法可用于
现有系统的变更实施。
1.5 本指南适用于制造系统的整个生命周期,从概念设计直至退
役。
1.6 整个设施(如污染控制策略(中国化学会))的质
量风险管理影响不属于评估范围,需进行单独评估;然
而,这些评估的输出结果可作为工艺风险和/或风险缓解措
施的输入,这些措施可能随后用于制造系统的评估。
1.7
本标准不涉及员工健康安全、环境或其他非
GxP
(通用良好规范)法规。本标准不声称涵盖其使用过程中
可能存在的所有安全问题(如有)。用户有责任建立适当
的安全、健康及
在使用前评估环境实践并确定监管限制的适用性。
1.8
本国际标准是根据世界贸易组织技术性贸易壁垒
(
TBT
)委员会发布的《关于制定国际标准、指南和建议
的原则的决定》中确立的国际公认标准化原则制定的。
2. 参考文献
2.1 ASTM
标准:
²
E2363制药和生物制药产品生产相关的术语
非洲和生物制药行业E2474利用
过程分析技术(2020年撤回)³
E2476风险评估和风险控制指南
影响PAT的设计、开发和运营
药品生产过程
E2537药品和生物制品连续工艺验证应用指南
开票
E2629工艺分析技术(PAT)控制系统的验证指南
E3051规范、设计、验证和
一次性使用系统在制药领域的应用
生物制药生产
2.2 FDA
文件: ⁴
EU GMP附录11计算机系统
EU GMP 附件15 资质与确认
FDA行业工艺验证指南一般原则和实践
本指南由ASTM委员会E55药品和生物制品生产管辖,由工艺设计分委员会E
55.11直接负责。
现行版本于2025年3月15日批准,2025年4月发布。最初于2007年批准,上
一版本于2020年作为E2500-20批准。DOI:10.1520/E2500-25 。
www.astm.org²For 如需参考ASTM标准,请访问ASTM 网站 , 或联系 AS-
TM客户服务部,电话: www.astm.org/contact 。如需了解《ASTM标准年鉴》
卷信息,请访问ASTM网站上的标准文件摘要页面。
³The 该历史标准的最后批准版本可参考www.astm.org。
4可从美国食品药品监督管理局(FDA)获得,地址:5600 Fishers Ln.,Rockville,MD
20857,http://www.fda.gov。
版权 所 有 OASTM International,100 Barr Harbor Drive,PO Box C700,West Conshohocken,PA 19428-2959. United
States工
FDA指南第11部分 电子记录;电子签名
自然的范围和应用
FDA制药cGMP指南——21世纪
风险导向方法
2.3 ICH Documents:⁵
ICH Q7活性药物成分ICH Q8(R2)药物开发
ICH Q9(R1)质量风险管理ICH Q10药品
质量体系
ICHQ11原料药的开发与生产
(化学实体与生物技术/生物实体
绑结
ICHQ12药品的技术和监管考虑
药品产品生命周期管理——科学指南
ICH Q13原料药的连续生产
以及《药品行业指南》
2.4
其他出版物:
ISPE 《基线5调试和资格认证指南》第二版⁶
ISPE 《良好工程实践指南》(GPG)(GEP)第二版⁶
美国药典 <1058> 分析仪器认证及其
对色谱法的影响 Laboratory⁷
ISO 14971风险管理⁸
3. 术语
3.1 定义—有关本指南中使用的术语定义,请参阅术语E2363。
3.1.1
验收标准,
n
—数值限值、范围或
其他适合的测试
结果验收措施(ICH Q7)。系统或组件必须满足的标准,
以便用户或其他授权实体接受。
3.1.2 调试(n)——指通过计划、管理及文档化流程,对设
备、自动化系统及整体进行调试、启动、调节、调整,并
完成安装、运行及性能验证,最终使系统达到安全标准并
满足终端用户需求的完整运行状态。
3.1.3
制造系统的关键方面,
n
—
通常指制造过程和系统
为确保关键工艺参数得到持续控制并满足其他要求(如法
规要求)所必需的功能、特性、能力、性能或特征。应根
据科学的产品和工艺理解来识别和记录这些关键方面。
3.1.3.1
讨论——为简洁起见,本文仅讨论
manu
的关键方面——
5可从人用药品注册技术要求国际协调会议(ICH)获取,ICH秘书处,9,
chemin des Mines,P.O.Box 195,1211 Geneva 20,Switzerland,http://www.ich.org。
⁶Available 来自国际制药工程学会(ISPE),3001 N Rocky Point Dr. East,Suite 200,Tampa,FL
33607,http://www.ispe.org。
⁷Available U.S.Pharmacopeial Convention(USP),12601 Twinbrook Pkwy.,Rockville,MD
20852-1790,http://www.usp.org。
8可从国际标准化组织(ISO),ISO中央秘书处,Chemin de Blandonnet 8,CP
401,1214 Vernier,Geneva,Switzerland,https://www.iso.org.
在本指南后续内容中,开票系统将被统称为关键要素。
3.1.4
关键设计要素(
CDE
)、
n-
组件、
仪器、结构材料
和工程系统特征,这些要素对于持续实现必要的过程控制
以生产出符合关键质量属性(CQA)的产品是必需的。
3.1.4.1 讨论——自动化功能示例包括报警能力与数据管
理能力。CDE(临床数据事件)的识别与记录基于对产品
CQA(临床质量分析)、CPP(工艺控制点)及设备设计/
自动化的技术理解。CDE通过调试与确认(C&Q)进行验
证。CDE是设计开发生命周期的输出结果。
3.1.5
关键工艺参数(
CPP
),
n
——
对关键质量属性有
影响的工艺参数,因此应对其进行监测或控制,以确保工
艺生产出所需质量。
3.1.6
关键质量属性(
CQA
),
n-应当处于适当限度、范
围或分布内的理化、生物学或微生物学性质或特征,以确
保达到预期(ICH Q8(R2))产品质量。
3.1.7 设计评审,即对规范、设计及设计开发进行计划性
与系统性评审,并在制造系统全生命周期内适时实施持续
改进变更。
3.1.7.1 讨论——设计评审通过标准和用户需求评估交付
成果,识别问题并提出必要的纠正措施。设计应在预设阶
段进行评审,并在开发过程中适当记录,以解决特定问
题,包括通过质量风险管理分析的潜在危害。
3.1.8
设计确认(
DQ
)
n-
记录的过程
,用于验证设施、系
统、公用工程和设备的拟定设计是否适合预期用途,并且
是否符合EU GMP 附录15和FDA行业指南工艺验证。
3.1.9
直接影响系统,
n
——直接影响
产品CQA,或直接
影响关键公用系统交付产品质量的系统。
3.1.9.1 讨论——所有其他系统均被认为无直接影响。
3.1.10 工程系统,n——该术语包括根据 GEP 设计、交
付和维护整个生命周期的所有系统,包括定制设计、自行
制造、目录和商用现成系统。
3.1.11
通用用户要求(
GUR
)——需满足——
与工艺能力、设备可用性、环境排放、安全和其他典型的
非GMP 要求有关的事项。
3.1.11.1 讨论 -通常在产品和过程用户要求(PUR)之外
定义GUR,并统称为“一般用户要求”,以区别于可能影
响产品质量的那些要求。一般用户要求通过 GEP 进行管
理。
2
3.1.12
良好工程实践(
GEP
)
n-
在项目全生命周期中应
用的已确立
工程方法和标准,以提供适当、经济高效的解
决方案。
3.1.12.1 讨论——在ISPE 良好实践指南(GPG)中,
GEP 是指一套系统,确保工程系统根据用户需求、利益相
关者期望和质量要求,以适合预期目的的方式一致且可靠
地设计、交付和操作,并在整个生命周期中保持受控状
态,以最小化对产品质量和患者安全的风险。
3.1.13
生产系统,制药和生物制药生产能力的
n
个要素
,
包括可能影响产品质量和患者安全的生产系统、设施设
备、工艺设备、辅助公用设施、相关工艺监控系统和自动
化系统。
3.1.14
工艺用户要求(
PUR
)
n
—
—包括关键质量属性
(CQA)、关键工艺参数(CPP)和其他关键支持系统,
以及可能影响产品清洁、灭菌、消毒或生产能力的任何支
持性技术设计特征或控制功能,这些活动对产品质量和安
全性有影响。
3.1.14.1 讨论-PUR是关键产品质量要素,使产品符合使
用要求,如 QTPP 、设计空间以及监管通用技术文件和所
有者公司质量体系文件中所述。
3.1.15 资质认证,n——一种系统性方法,用于确认制造
系统单独或联合使用时,是否适用于预期用途,以确保患
者安全和产品质量。
3.1.15.1 讨论——验证始于确定在特定生产环境中的适
用性,通常基于工艺和质量风险控制策略,最终以正式验
收和放行用于生产,并随后进行生命周期持续改进。验证
构成FDA行业指南《工艺验证》的第2a阶段。
3.1.16
专业人员(
SMEs
),即在特定领域或行业具有
特定专
业知识和责任的个人(用于 质量 单位,工程,自动
化,
开发、运营等)。
3.1.17
质量风险管理(
QRM
)
n-
一种系统
的过程,用于
评估、控制、沟通和审查药品(医药)产品整个生命周期
中对质量的风险。
3.1.17.1 讨论——风险管理这一术语泛指风险管理,包
括产品质量和患者安全风险、业务风险、项目风险、健
康、安全和环境(HSE)风险等。 QRM 和一般风险管理
在风险管理过程中可以使用相同的流程和工具。关键区别
在于, QRM 特别关注与产品质量和患者安全相关的流程
风险管理。
评估是应用 QRM 检查直接影响系统产品质量风险控制措
施的过程。该评估可识别出为将系统风险降低到可接受水
平而需要的关键设计控制措施(CAs/CDEs)和程序控制措
施。
3.1.17.2 讨论——项目团队在进行系统风险评估时,纳
入理解该流程科学原理及与CQA 相 关 风 险 的 技 术 专 家
(SME)至关重要。
3.1.18
质量目标产品概要(
QTPP
),
n
——
一种药物产品的
质量特征的前瞻性总结,理想情况下应达到该质量特征,以确
保药物产品的预期质量,同时考虑药物产品的安全性和有效
性。
3.1.19 用于支持制造作业的系统、设施、公用工程和/或设备。
3.1.20 系统所有者——指负责系统开发、采购、集成、
修改、运行、可用性、维护、支持以及系统内数据安全的
个人或职能。
3.1.21 验证(n)——这一宽泛术语涵盖一系列具体措施,
旨在以高度可信度确认特定制造工艺、配置方案、安装方
式、运行模式或性能指标均已达标,并符合预期用途。
3.1.21.1 讨论——验证行动可包含多种类型,包括物理
检查、结构或功能测试、文件审查、性能监测等。调试与
确认活动属于验证范畴。
4. 指南摘要
4.1 本指南阐述了一种基于科学与风险的制造系统及设
备规范、设计、验证与确认方法,这些系统及设备可能影
响产品质量与患者安全。
4.2 本指南阐述了一种系统、高效且有效的方法,用于
确保制造系统和设备符合预期用途,并有效管理产品质量
和患者安全风险。
4.3 该方法为制药及生物制药设备、系统、设施及相关
自动化设备的资质认证提供了一种有效的方法学。
4.4 本标准聚焦于影响制造系统与设备关键工艺参数
(CPP)的关键方面及关键要素。制造程序的其他要素,
如制造物料/组件控制、标准操作规程(SOP)、批次记录
及过程中检测,均属于工艺验证的范畴,故不包含于本标
准中。
4.5 本指南所述方法还支持持续改进过程能力,并且能
够实现创新,例如实施过程分析技术(PAT)和一次性使
用系统(SUS)。有关PAT系统风险评估和验证的进一步
指导,请参阅指南E2476和E2629。有关SUS的指导,请参
阅指南E3051。
4.6 本指南的主要内容包括:
3
摘要:
展开>>
收起<<
本国际标准是根据世界贸易组织技术性贸易壁垒委员会(TBT)发布的《关于制定国际标准、指南和建议的原则的决定》中确立的国际公认标准化原则制定的。Designation:E2500-25INTERATIONAL标准指南药品的规格、设计与验证以及生物制药生产系统装备科学与基于风险的方法1本标准采用固定编号E2500发布;紧随编号后的数字表示发布年份。原始采纳年份,或在修订情况下,末次修订年份。括号内数字表示末次重新批准年份。上标ε(e)表示自上次修订或重新批准以来的编辑变更1.范围1.1本指南适用于制药和生物制药生产系统的所有要素,包括:药品生产质量管理规范(GMP)公用设备、工艺设备、辅助公用设备...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
ASTM F3172-15 血管内医疗器械设计验证数量和样本容量选择指南

 2024-04-15 138
2024-04-15 138 -
ASTM-D-882-测量塑料薄膜和薄片材拉伸性能(

 2024-04-16 103
2024-04-16 103 -
ASTM F838-2015 确定用于液体过滤的膜过滤器的细菌滞留的标准试验方法

 2024-05-09 98
2024-05-09 98 -
ASTM F3064-21 Standard Specification for Normal Category Aeroplanes CertificationVIP免费

 2024-05-09 58
2024-05-09 58 -
ASTM D3195 D3195M-10(2015) Standard Practice for Rotameter CalibrationVIP免费

 2024-05-09 66
2024-05-09 66 -
ASTM D4169-22 运输集装箱和系统的性能测试1(中文版)VIP免费

 2025-09-09 56
2025-09-09 56 -
ASTM D4169 运输集装箱和设备性能试验的标准实施规范(中英文)VIP免费

 2025-09-09 42
2025-09-09 42 -
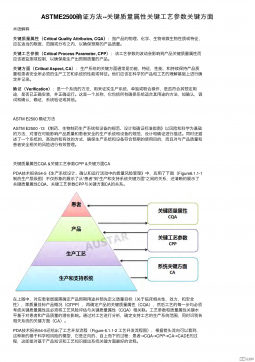
ASTME2500 确证方法--关键质量属性关键工艺参数关键方面VIP免费
 2025-09-26 26
2025-09-26 26 -
ASTM E2500-25 药品的规格、设计与验证以及生物制药生产系统装备科学与基于风险的方法1(中文)VIP免费

 2025-11-21 86
2025-11-21 86 -
ASTM E3219-25 基于健康的暴露限值(HBEL)推导指南(中文)

 2025-12-17 82
2025-12-17 82
作者: 51zlzl
分类:法规规范
价格:100质量币
属性:10 页
大小:1.64MB
格式:PDF
时间:2025-11-21


