医疗器械现场检查整改报告
VIP免费
医疗器械现场检查整改报告
受理编号:
企业名称 检查地址 )
检查类型 检查时间
联系人 联系电话
产品名称
检查依据 医疗器械生产质量管理规范
现场检查
情况
不符合项共计:条
整改情况
完成整改: 条
计划整改: 0 条
完成时间: 年 月 日
序
号
检查依
据及条
款
不符合项描述 原因分析 整改及纠正预防措施
1
医疗器
械生产
质量管
理规范
附录
3.2.1
生产用电脑非
专用电脑,还
用 于 研 发 设
计;生产部门
缺
少独立的天平
1. 因3D 打印软
件和研发软件均
安装在研发电脑
里,方便研发、
打印生产使用,
但未考虑到生产
用电脑需要专
用。
2.生产部使用的
是检验室的天
平,未考虑再单
独配置独立的天
平。
整改措施:
1. 将《生产设备管理台账》中的 2
台计算机列为生产专用的电脑,专门
用于 3D 打印生产用,详见附件 1-
1。
2. 配备一台专用的电子秤给生产部
门专用,详见附件 1-2。
纠正预防措施:
1.对生产部进行《基础设施控制程
序》和《计算机使用管理制度》的培
训,详见附件 1-3。
2.新增《电子秤操作及维护保养规
程》,并对生产部进行培训,详见附
件1-4。
2
医疗器
械生产
质量管
理规范
附录
3.2.2
生产用 U盘未
有设备标签
因U盘较小,且
只作为模型图片
的传输载体,未
考虑作为生产设
备进行标识管
理。
整改措施:
1. 将U盘 纳 入 《 生 产 设 备 管 理 台
账》,进行编号管理,并对 U盘进行
标识,详见附件 2-1。
纠正预防措施:
1. 新增《U盘管理制度》,对 U盘
的管理进行规定,详见附件 2-2。
2. 对生产部进行《U盘管理制度》、
《设备管理制度》、《标识及状态的
管理制度》培训,详见附件 2-3。
3
医疗器
械生产
质量管
理规范
附录
4.4.2
成品检验记录
表中未记录外
观检测使用的
“5 倍 放 大
镜”
设备信息
未有意识要将 5
倍放大镜作为检
测设备管理,因
此成品检验记录
表中未填写检测
设备信息。
整改措施:
1.将5倍放大镜纳入《监视和测量设
备管理台账》,进行编号管理,并对
5倍放大镜进行标识,详见附件 3-
1。
2.在《成品检验记录表》 “外观”检
测中,增加 5倍放大镜的检测设备和
编号信息,详见附件 3-2。
纠正预防措施:
1.质量部进行《监视和测量设备控制
程序》、《关于监测、测量设备的使
用、维护和保养的管理制度》培训,
详见附件 3-3。
摘要:
展开>>
收起<<
医疗器械现场检查整改报告受理编号:企业名称检查地址)检查类型检查时间联系人联系电话产品名称检查依据医疗器械生产质量管理规范现场检查情况不符合项共计:条整改情况完成整改:条计划整改:0条完成时间:年月日序号检查依据及条款不符合项描述原因分析整改及纠正预防措施1医疗器械生产质量管理规范附录3.2.1生产用电脑非专用电脑,还用于研发设计;生产部门缺少独立的天平1.因3D打印软件和研发软件均安装在研发电脑里,方便研发、打印生产使用,但未考虑到生产用电脑需要专用。2.生产部使用的是检验室的天平,未考虑再单独配置独立的天平。整改措施:1.将《生产设备管理台账》中的2台计算机列为生产专用的电脑,专门用于3D...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
RBA8.0官方中文版VIP免费

 2025-11-16 19
2025-11-16 19 -
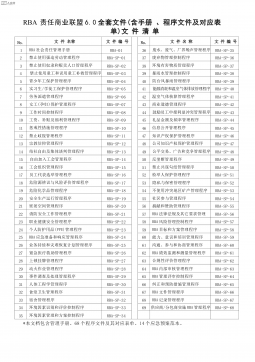
新版RBA责任商业联盟一整套文件(含管理手册、全套程序文件及对应表单)
 2025-11-17 35
2025-11-17 35 -
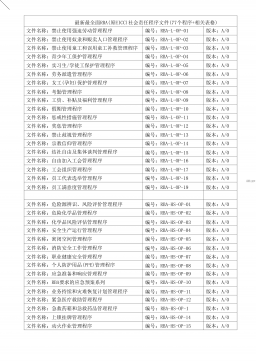
最新最全面RBA(原EICC)社会责任程序文件(77个程序+相关表格)
 2025-11-17 28
2025-11-17 28 -
RBA-SP-067 供应商分包商实施RBA管理程序

 2025-11-18 25
2025-11-18 25 -
RBA-SP-066 记录管理程序

 2025-11-18 25
2025-11-18 25 -
RBA-SP-065 文件管理程序

 2025-11-18 20
2025-11-18 20 -
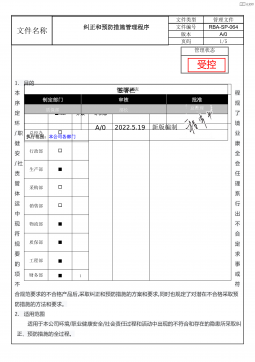
RBA-SP-064 纠正和预防措施管理程序RBA8.0
 2025-11-18 24
2025-11-18 24 -
RBA-SP-063 管理评审控制程序

 2025-11-18 19
2025-11-18 19 -
RBA-SP-062 内部审核管理程序

 2025-11-18 29
2025-11-18 29 -
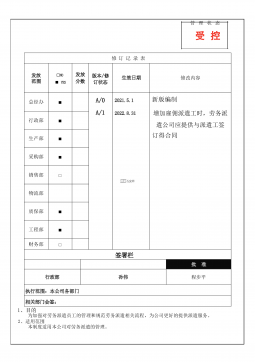
RBA-SP-006 劳务派遣管理程序
 2025-11-18 29
2025-11-18 29
作者:冒牌货
分类:专业资料
价格:20质量币
属性:2 页
大小:18.07KB
格式:DOCX
时间:2025-12-31


