医疗器械生产企业质量控制与成品放行指南



摘要:
展开>>
收起<<
附件医疗器械生产企业质量控制与成品放行指南医疗器械生产企业(以下简称企业)应当按照《医疗器械生产质量管理规范》(国家食品药品监督管理总局公告2014年第64号)及其附录的要求,加强对产品实现全过程,特别是采购和生产过程的质量控制以及成品放行的管理,确保放行的医疗器械符合强制性标准以及经注册或者备案的产品技术要求。一、适用范围本指南所指质量控制,包括与产品有关的主要原材料、零部件、外协件、中间品、成品、初包装材料、标签等相关的验证/确认/监视/测量/检验/试验活动及其质量管理,也包括与生产过程相关的,特别是与生产过程中关键工序和特殊过程相关的验证/确认/监视/测量/检验/试验活动及其质量管理。本...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
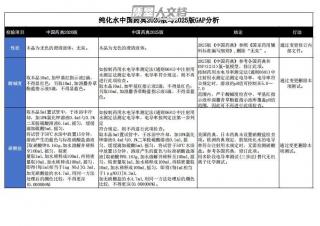
纯化水中国药典2020版与2025版GAP分析VIP免费
 2025-04-18 273
2025-04-18 273 -
无菌检查法对比表(2025版药典 VS 2020版药典)

 2025-09-27 255
2025-09-27 255 -
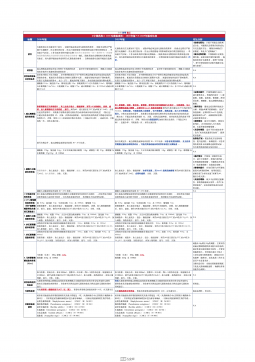
1101无菌检查法对比表(2025版药典 VS 2020版药典)
 2025-09-29 194
2025-09-29 194 -
1143 细菌内毒素检查法对比表(2025版药典 VS 2020版药典)

 2025-09-29 456
2025-09-29 456 -
ECA-污染控制策略指南(中英文)-202202VIP免费

 2025-11-04 48
2025-11-04 48 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(中英文对照版)VIP专享

 2025-11-06 351
2025-11-06 351 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(英文版)VIP免费

 2025-11-06 99
2025-11-06 99 -
PDA-TR49-生物清洁验证-中英文翻译

 2025-11-19 39
2025-11-19 39 -
ISPE 除热原隧道的验证alidation of a Depyrogenation Tunnel-2025(中英文)VIP免费

 2025-11-25 31
2025-11-25 31 -
药包材GMP培训2025VIP免费

 2025-12-04 23
2025-12-04 23
作者:宁静致远
分类:法规规范
价格:免费
属性:8 页
大小:20.63KB
格式:DOCX
时间:2024-10-12


