ISO 10993-1-2018 医疗器械生物学评价 第1部分:风险管理过程中的评价与试验_中文版
©ISO 2018
医疗器械生物学评价——
第1部分:
风险管理过程中的评估和测试
医疗器械生物学评价
第一部分:风险管理流程中的评估与测试
国际标准 ISO
10993-1
2018 年8月
第五版
参考编号ISO 10993-
1:2018(E)
不得转售,2018年8月20日20:10:24 MDT未经IHS许可,禁止复制或联网
-
-、/、、//、//、、、/、/、//、//、//、、、、、/-、-、//、//、/、//、---版权归属国
际标准化组织(ISO),由IHS Markit根据ANSI许可协议提供
ISO 10993-1:2018(e)
ii ©ISO 2018-版权所有
受版权保护的文档
© ISO 2018
版权所有。除非另有规定或实施要求,未经书面许可,不得以任何形式(包括电子或机械方式,如复印、
互联网或内联网发布)复制或使用本出版物的任何部分。许可申请可提交至以下地址的ISO机构,或申请
人所在国的ISO成员国机构。
ISO版权办公室
CP 401 • Ch. de Blandonnet 8
CH-1214 Vernier,Geneva
电话:+41 22 749 01 11
电子邮件:copyright@iso.org
网站:www.iso.org
在瑞士出版
C
不得转售,2018年8月20日20:10:24 MDT
版权归国际标准化组织所有,由IHS Markit根据ANSI授权提供。
未经IHS许可,禁止复制或联网。
` `` ` ``` ` ` ` ` ````` ` ` ` ` ` `
-- - - ---, ,, ,, , , ,, ,, ,, , ,, ,, , ,,
ISO 10993-1:2018(e)
前言................................................................................................................................................................................................................................................... IV
介绍...................................................................................................................................................................................................................................................... v
1范围..................................................................................................................................................................................................................................... 1
2规范性参考文件..................................................................................................................................................................................................... 1
3术语和定义.................................................................................................................................................................................................................. 2
4医疗器械生物学评价的通用原则...................................................................................................................................................... 5
5医疗器械分类......................................................................................................................................................................................................... 9
5.1 概要............................................................................................................................................................................................................... 9
5.2 按身体接触性质分类............................................................................................................................................................ 9
5.2.1 非接触式医疗器械....................................................................................................................................................... 9
5.2.2 表面接触式医疗器械.............................................................................................................................................. 10
5.2.3 与外部通信的医疗器械............................................................................................................................10
5.2.4 植入式医疗器械........................................................................................................................................................... 11
5.3 按联系时长分类...................................................................................................................................................................... 11
5.3.1 联系人持续时间类别................................................................................................................................................11
5.3.2 临时接触式医疗器械................................................................................................................................... 11
5.3.3 具有多个接触持续时间类别的医疗器械..............................................................................................11
6生物学评价过程..................................................................................................................................................................................................12
6.1 生物学风险分析的物理和化学信息.............................................................................................................. 12
6.2 评估的差距分析和生物学终点选择............................................................................................................. 12
6.3 生物学试验............................................................................................................................................................................................. 13
6.3.1 概要...................................................................................................................................................................................... 13
6.3.2 测试以供评估................................................................................................................................................................. 14
7生物学评价数据的解释和整体生物学风险评估............................................................................................................... 18
附录A(信息性)生物学风险评估中涉及的终点.............................................................................................................................. 20
附录B(资料性)风险管理过程中的生物学评价实施指南.............................................................................................................. 25
附录C(信息性)文献综述建议流程............................................................................................................................................................. 38
参考文献....................................................................................................................................................................................................................................... 40
1 – iii
目录 页
版权所有国际组织©aniI
Copyright International Organization for Standardization
<sp_0
Copyright International Organization for Standardization
tan8
Copyright International Organization for Standardization
ardizA
Copyright International Organization for Standardization
蒂l
Copyright International Organization for Standardization
l
Copyright International Organization for Standardization
版权所有,由IHS Markit根据ANSI授权
提供
不得转售,2018年8月20日20:10:24 MDT
未经IHS许可,禁止复制或联网
--`,``,,`,,```,`,`,,`,,`,,`````,-`-`,,`,,`,`,,`---
摘要:
展开>>
收起<<
©ISO2018医疗器械生物学评价——第1部分:风险管理过程中的评估和测试医疗器械生物学评价第一部分:风险管理流程中的评估与测试国际标准ISO10993-12018年8月第五版参考编号ISO10993-1:2018(E)不得转售,2018年8月20日20:10:24MDT未经IHS许可,禁止复制或联网--、/、、//、//、、、/、/、//、//、//、、、、、/-、-、//、//、/、//、---版权归属国际标准化组织(ISO),由IHSMarkit根据ANSI许可协议提供ISO10993-1:2018(e)ii©ISO2018-版权所有受版权保护的文档©ISO2018版权所有。除非另有规定...
声明:如果您的权利被侵害,请联系我们的进行举报。
相关推荐
-
纯化水中国药典2020版与2025版GAP分析VIP免费
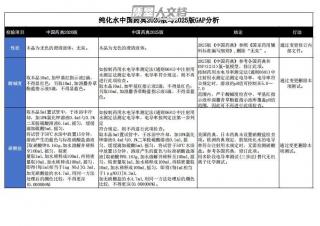
 2025-04-18 315
2025-04-18 315 -
无菌检查法对比表(2025版药典 VS 2020版药典)

 2025-09-27 402
2025-09-27 402 -
1101无菌检查法对比表(2025版药典 VS 2020版药典)
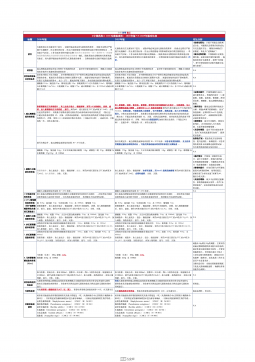
 2025-09-29 295
2025-09-29 295 -
1143 细菌内毒素检查法对比表(2025版药典 VS 2020版药典)

 2025-09-29 639
2025-09-29 639 -
ECA-污染控制策略指南(中英文)-202202VIP免费

 2025-11-04 68
2025-11-04 68 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(中英文对照版)VIP专享

 2025-11-06 409
2025-11-06 409 -
TR-26-2025-Sterilizing-Filtration-of-Liquids液体的灭菌过滤(英文版)VIP免费

 2025-11-06 131
2025-11-06 131 -
PDA-TR49-生物清洁验证-中英文翻译

 2025-11-19 88
2025-11-19 88 -
硫酸艾玛昔替尼片(CXHS2300097)说明书VIP免费

 2025-11-26 185
2025-11-26 185 -
达格列净片说明书VIP免费

 2026-01-13 29
2026-01-13 29
作者:多多猪
分类:法规规范
价格:120质量币
属性:48 页
大小:2.34MB
格式:PDF
时间:2025-11-03


